La découverte contribue à élucider le rôle d’enzymes intervenant dans la formation d’amyloïdes
Les amas de protéines que sont les amyloïdes sont en cause dans diverses affections humaines, dont la maladie d’Alzheimer. En tant qu’élément déclencheur de la formation d’amyloïdes dans cette maladie, l’enzyme bêta-sécrétase (BACE1) est devenue une cible privilégiée des efforts visant à la prévenir. Jusqu’ici pourtant, l’état cellulaire de cette enzyme restait obscur.
Or, une étude réalisée par des chercheurs de la Faculté de médecine de l’Université McGill fait avancer la compréhension de l’état cellulaire de la BACE1 en révélant un rôle imprévu de l’enzyme. Les résultats de l’étude ont récemment été publiés dans le Journal of Biological Chemistry.
 « En matière d’Alzheimer, l’objectif final est de mettre au point des inhibiteurs à petites molécules qui pourraient diminuer la production d’amyloïdes », explique le Pr Gerhard Multhaup, directeur du Département de pharmacologie et de thérapeutique à l’Université McGill et auteur principal de l’étude.
« En matière d’Alzheimer, l’objectif final est de mettre au point des inhibiteurs à petites molécules qui pourraient diminuer la production d’amyloïdes », explique le Pr Gerhard Multhaup, directeur du Département de pharmacologie et de thérapeutique à l’Université McGill et auteur principal de l’étude.
Menée en collaboration avec la Freie Universität et la Humboldt Universität de Berlin ainsi que l’Université de Montréal, l’étude s’est heurtée à plusieurs obstacles. Il y a quelques années, les chercheurs ont entrepris de purifier la BACE1 provenant de tissus cérébraux humains afin de bien comprendre sa fonction. L’une des méthodes privilégiées à l’époque supposait de séparer la BACE1 de protéines se liant aux ions métalliques au moyen d’une technique de chromatographie. Contre toute attente, ils ont découvert que la BACE1 demeurait liée à la colonne chromatographique, un indice de son interaction avec les ions métalliques. Un examen plus approfondi a permis de trouver un motif potentiel de liaison au cuivre dans la région transmembranaire qui arrime la protéine aux membranes cellulaires.
 Dans la plus récente étude, son premier auteur, Filip Liebsch, alors doctorant au laboratoire du Pr Multhaup, a confirmé que la BACE1 peut en effet se lier aux ions de cuivre, et a découvert que cette interaction a une fonction dans la régulation de la distribution du cuivre à l’intérieur des cellules. « C’est très important, car le cuivre est un micronutriment essentiel et un cofacteur de plus d’une trentaine d’enzymes, et son transport dans la cellule doit être bien régulé, vu les possibles effets toxiques », explique le Pr Multhaup. De concert avec d’autres chercheurs montréalais, Filip Liebsch a aussi constaté que la BACE1 n’existe pas en tant qu’enzyme isolée, mais forme plutôt des complexes, qui comprennent trois unités de la protéine. « Notre découverte est une première étape pour résoudre la structure complète de cette enzyme importante, et elle pourrait mener à une conception rationnelle améliorée d’inhibiteurs allostériques et compétitifs afin de freiner la production d’amyloïdes », note le Pr Multhaup. « Il faut absolument trouver de tels inhibiteurs en vue d’approches thérapeutiques n’entravant pas le clivage d’autres substrats. »
Dans la plus récente étude, son premier auteur, Filip Liebsch, alors doctorant au laboratoire du Pr Multhaup, a confirmé que la BACE1 peut en effet se lier aux ions de cuivre, et a découvert que cette interaction a une fonction dans la régulation de la distribution du cuivre à l’intérieur des cellules. « C’est très important, car le cuivre est un micronutriment essentiel et un cofacteur de plus d’une trentaine d’enzymes, et son transport dans la cellule doit être bien régulé, vu les possibles effets toxiques », explique le Pr Multhaup. De concert avec d’autres chercheurs montréalais, Filip Liebsch a aussi constaté que la BACE1 n’existe pas en tant qu’enzyme isolée, mais forme plutôt des complexes, qui comprennent trois unités de la protéine. « Notre découverte est une première étape pour résoudre la structure complète de cette enzyme importante, et elle pourrait mener à une conception rationnelle améliorée d’inhibiteurs allostériques et compétitifs afin de freiner la production d’amyloïdes », note le Pr Multhaup. « Il faut absolument trouver de tels inhibiteurs en vue d’approches thérapeutiques n’entravant pas le clivage d’autres substrats. »
Les chercheurs tenteront d’identifier d’autres partenaires qui interagissent et pourraient participer à cette nouvelle fonction régulatrice de la BACE1. Une caractérisation plus poussée de la structure cellulaire de la protéine dans un complexe avec ses substrats pourrait être utile aux fins d’approches pharmacologiques.
Bien que l’objectif soit l’inhibition de la production d’amyloïdes, le Pr Multhaup prévient que, compte tenu de la promiscuité de l’enzyme avec divers substrats, l’inhibition générale de la BACE1 donnerait probablement lieu à de multiples effets secondaires. « Nous estimons crucial de comprendre à fond toute la structure de la BACE1 dans des complexes avec ses substrats, afin de réussir une conception rationnelle d’inhibiteurs spécifiques aux substrats », précise-t-il. « Vu les effets de la BACE1 sur le cuivre des cellules, toute approche thérapeutique visant à diminuer les taux de cette enzyme doit être envisagée avec précaution, à cause des possibles effets secondaires dans l’homéostasie du cuivre. »
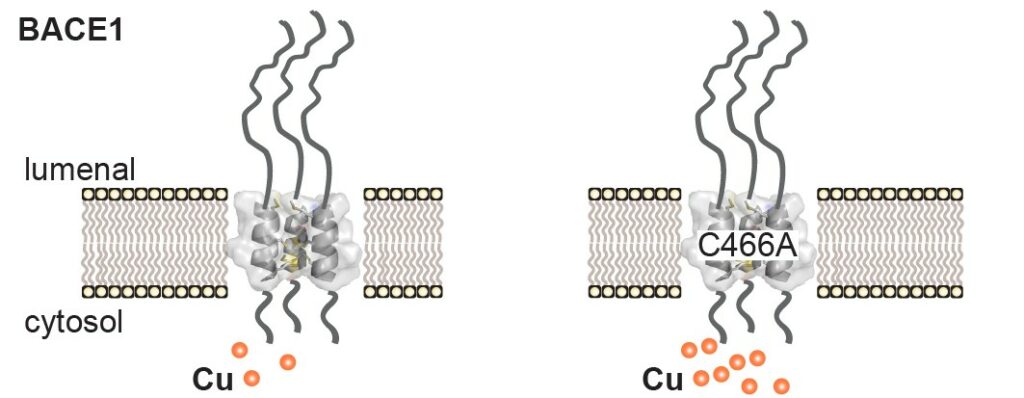
« Full-length cellular β-secretase has a trimeric subunit stoichiometry, and its sulfur-rich transmembrane interaction site modulates cytosolic copper compartmentalization », Filip Liebsch, Mark R. P. Aurousseau, et al. Journal of Biological Chemistry, 21 juin 2017
DOI : 10.1074/jbc.M117.779165
Cette étude a été financée en partie par le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG), la Fondation canadienne pour l’innovation (FCI), le programme des chaires de recherche du Canada (CRC), l’International Copper Association, la Studienstiftung des Deutschen Volkes, le Groupe de recherche axé sur la structure des protéines (GRASP), les Instituts de recherche en santé du Canada (IRSC) et le Fonds de recherche du Québec – Santé (FRQS).
Le 4 octobre 2017
